درمان آلزایمر با میکروگلیاهای سلول بنیادی پرتوان: تحولی در انتقال پروتئینهای درمانی به مغز

مقدمه: نقش سلول بنیادی در درمان هدفمند بیماریهای عصبی
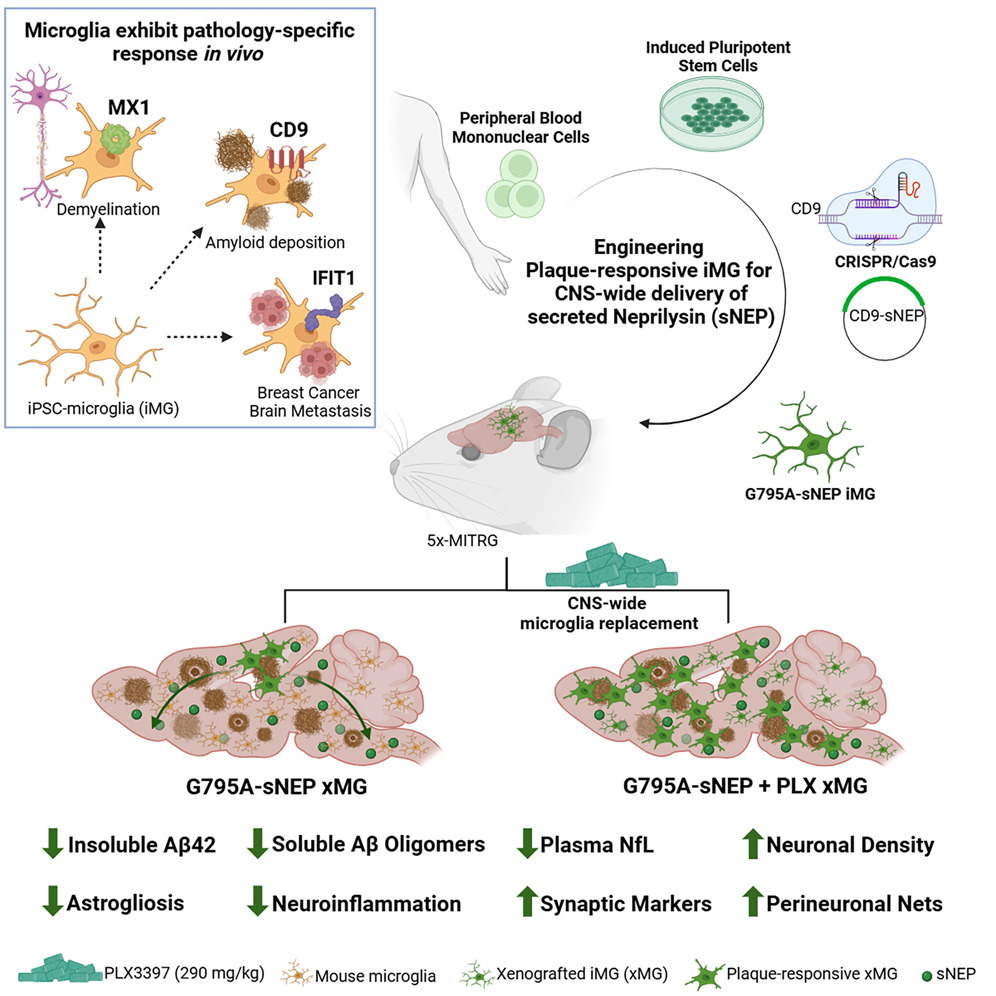
انتقال پروتئینهای درمانی به مغز یکی از چالشهای اصلی در پزشکی عصبی است. سد خونی-مغزی (BBB) مانع بزرگی برای ورود داروها به سیستم عصبی مرکزی (CNS) ایجاد میکند. در این راستا، استفاده از میکروگلیاهای مشتق از سلولهای بنیادی پرتوان القاشده انسانی (iPSC-microglia یا iMG) بهعنوان یک رویکرد نوین برای انتقال هدفمند درمانها مورد توجه قرار گرفته است. پژوهشگران با استفاده از فناوری CRISPR، میکروگلیاهایی را مهندسی کردهاند که آنزیم تجزیهکننده آمیلوئید بتا (Aβ)، یعنی نپریلیسین، را تحت کنترل پروموتر پاسخگو به پلاک CD9 بیان میکنند. این روش امکان پاسخ هوشمند به پاتولوژیهای عصبی مانند آلزایمر را فراهم میکند.
برای افزایش ماندگاری این سلولهای بنیادی مهندسیشده در مغز، از رویکرد مقاومت به بازدارنده CSF1R استفاده شده است. نتایج نشان میدهد که پیوند گسترده میکروگلیاها در مغز موشهای مدل آلزایمر (5xFAD) نهتنها نشانگرهای بیوشیمیایی پاتولوژی را کاهش میدهد، بلکه بار پلاکی، نوریتهای دیستروفیک، آستروگلیوز و تخریب نورونی در ناحیه سابیکولوم را نیز بهطور قابلتوجهی بهبود میبخشد.
سد خونی-مغزی و چالشهای درمان با سلول بنیادی
سد خونی-مغزی شبکهای پیچیده از اجزای سلولی و غیرسلولی است که ورود مولکولها، پپتیدها و سلولها به مغز را بهشدت کنترل میکند. این ویژگی حفاظتی، اگرچه برای حفظ همایستایی عصبی ضروری است، اما مانع بزرگی برای رساندن داروهای زیستی به مغز محسوب میشود. تلاشهای غیرتهاجمی مانند استفاده از حاملهای زیستی یا ناقلهای مولکولی تنها کمتر از ۲٪ از غلظت پلاسمایی دارو را به مغز میرسانند، که این امر خطر سمیت سیستمیک را افزایش میدهد.
روشهای تهاجمی مانند تزریق مستقیم پروتئینها یا ناقلهای ویروسی به مغز نیز مشکلات خاص خود را دارند، از جمله نیاز به تکرار تزریقها، تحریک ایمنی و آسیب عصبی. در این میان، سلولهای بنیادی عصبی (NSC) اگرچه امیدبخش بودهاند، اما پتانسیل تومورزایی آنها نگرانیهایی را ایجاد کرده است. به همین دلیل، میکروگلیاهای مشتق از سلولهای بنیادی پرتوان (iPSC) بهعنوان جایگزینی ایمنتر و مؤثرتر معرفی شدهاند.
چرا میکروگلیاهای مشتق از سلول بنیادی؟
میکروگلیاها، سلولهای ایمنی ساکن مغز، به دلیل قابلیت جابهجایی و تعامل با نورونها، گزینهای ایدهآل برای انتقال درمانهای هدفمند هستند. پژوهشگران با تبدیل سلولهای بنیادی پرتوان انسانی به سلولهای پیشساز خونی و سپس به میکروگلیا، توانستهاند سلولهایی با رفتار و بیان ژنی مشابه میکروگلیاهای انسانی تولید کنند. برخلاف سلولهای بنیادی عصبی، میکروگلیاها هیچ پتانسیل تومورزایی از خود نشان ندادهاند، که این ویژگی آنها را به گزینهای ایمن برای درمان بیماریهای عصبی تبدیل میکند.
طراحی میکروگلیاهای هوشمند با استفاده از سلول بنیادی و CRISPR
تنظیم بیان نپریلیسین با پروموتر CD9
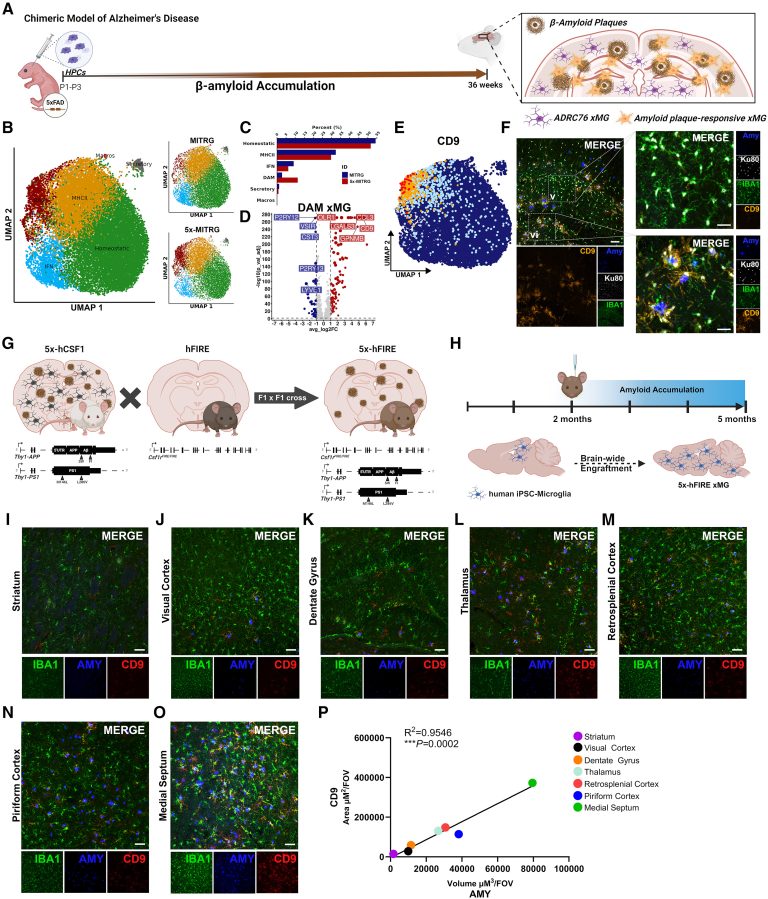
ژن CD9 بهعنوان یکی از شاخصترین ژنها در میکروگلیاهای پاسخدهنده به آمیلوئید (DAM) شناسایی شده است. این ژن در میکروگلیاهایی که در نزدیکی پلاکهای آمیلوئید قرار دارند، بیش از ۵ برابر افزایش بیان دارد. پژوهشگران از پروموتر CD9 برای هدایت بیان آنزیم نپریلیسین ترشحشونده (sNEP) استفاده کردند. این طراحی ژنتیکی به میکروگلیاها امکان میدهد تنها در حضور پلاکهای آمیلوئید، آنزیم ضدپاتولوژیک را ترشح کنند.
مهندسی ژنتیکی با CRISPR
با استفاده از فناوری CRISPR/Cas9، ساختار ژنتیکی موردنظر در جایگاه امن AAVS1 در ژنوم میکروگلیاها وارد شد. آنزیم نپریلیسین بهصورت ترشحشونده طراحی شد تا پپتیدهای Aβ را در فضای خارجسلولی تجزیه کند. آزمایشهای in vitro نشان داد که این سیستم تنها در حضور Aβ فعال میشود، که از بیان نابجای آنزیم در بافتهای سالم جلوگیری میکند.
نتایج پیوند میکروگلیاهای مشتق از سلول بنیادی در مدلهای حیوانی
بهبود پاتولوژی آلزایمر
در مدل موشی آلزایمر (5xFAD)، پیوند میکروگلیاهای مهندسیشده به دو صورت موضعی و گسترده انجام شد. در هر دو حالت، سطوح پپتیدهای Aβ کاهش یافت، اما پیوند گسترده نتایج بهتری نشان داد. این روش نهتنها بار پلاک و نوریتهای دیستروفیک را کاهش داد، بلکه آستروگلیوز را بهبود بخشید و تراکم نورونها در ناحیه سابیکولوم را حفظ کرد.
پاسخ تطبیقی به پاتولوژیهای مختلف
علاوه بر آلزایمر، میکروگلیاهای مشتق از سلولهای بنیادی در مدلهای متاستاز مغزی سرطان پستان و بیماریهای میلینزدایی نیز مورد بررسی قرار گرفتند. این سلولها بسته به نوع پاتولوژی، پاسخهای رونویسی متفاوتی نشان دادند، که نشاندهنده انعطافپذیری آنها برای درمان هدفمند انواع بیماریهای عصبی است.
نتیجهگیری: آینده درمانهای عصبی با سلول بنیادی
میکروگلیاهای مشتق از سلولهای بنیادی پرتوان انسانی با قابلیت مهندسی ژنتیکی دقیق، پتانسیل بالایی برای درمان بیماریهای عصبی مانند آلزایمر، متاستاز مغزی و بیماریهای میلینزدایی دارند. استفاده از پروموترهای پاسخگو به پاتولوژی مانند CD9 و فناوری CRISPR امکان انتقال هوشمند و ایمن پروتئینهای درمانی به مغز را فراهم میکند. انعطافپذیری این سلولها در پاسخ به پاتولوژیهای مختلف، آنها را به ابزاری قدرتمند برای توسعه درمانهای نوین عصبی تبدیل کرده است.
منبع
