متیلاسیون DNA چیست؟ (بخش ۱)

نگاهی تاریخی به یکی از بنیادیترین اصلاحات اپیژنتیکی
متیلاسیون DNA که امروزه یکی از مهمترین مکانیسمهای تنظیم بیان ژن محسوب میشود، نخستین بار در سال ۱۹۲۵ با شناسایی باز ۵-متیلسیتوزین در باکتریها گزارش شد. با این حال، در آن زمان اهمیت زیستی آن برای دانشمندان چندان روشن نبود. برای چندین دهه، نقش این تغییر شیمیایی کوچک در ژنوم موجودات زنده ناشناخته باقی ماند. اما با پیشرفت تحقیقات، دانشمندان دریافتند که ۵-متیلسیتوزین نه تنها در باکتریها، بلکه در تمامی حوزههای زیستی (از پروکاریوتها تا یوکاریوتها) حضور دارد و عملکردهای بیولوژیکی گسترده و حیاتی دارد.
امروزه ما به اطلاعات بینظیری دربارهی عوامل مؤثر در ایجاد، حفظ و حذف متیلاسیون DNA دست یافتهایم. نقشههای متیلاسیون با وضوح پایه بهسرعت در حال گسترشاند و امکان تحلیل دقیقتر فرآیندهای اپیژنتیکی را فراهم میکنند.با اینکه ابزارهای پیشرفتهای برای بررسی متیلاسیون داریم، هنوز بسیاری از جنبههای دقیق نقش آن در تنظیم ژنها، خصوصاً در سلولهای پستانداران، نیازمند بررسیهای بیشتر است. رمزگشایی از الگوهای متیلاسیون در مراحل مختلف رشد، بیماریها و شرایط محیطی، هنوز در جریان است. در این مقاله، با نگاهی تاریخی به مسیر پژوهش در حوزهی متیلاسیون DNA میپردازیم و برخی از آزمایشهای کلیدی که پایهگذار این علم بودهاند را معرفی میکنیم.
در خصوص اپی ژنتیک بیشتر بدانید
متیلاسیون DNA؛ یک تغییر شیمیایی ساده، اما با تأثیراتی عمیق
در آگوست ۱۹۹۷، رودولف یِنیش، یکی از پیشگامان عرصه، در مجله Trends in Genetics این پرسش را مطرح کرد که: «چرا باید همچنان به متیلاسیون DNA اهمیت بدهیم؟» اکنون با گذشت بیش از یک قرن از کشف آن در باکتریها (در سال ۱۹۲۵)، وقت آن است که نگاهی دوباره بیندازیم به اینکه:
چرا هنوز متیلاسیون مهم است؟
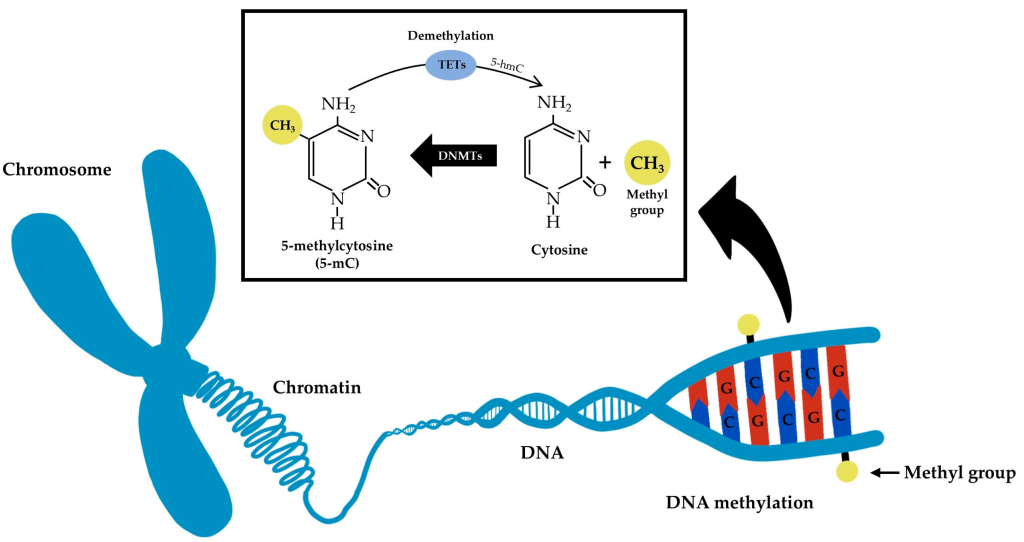
متیلاسیون DNA فرآیندی است که طی آن گروه متیل به باز سیتوزین در DNA اضافه میشود. این مکانیسم، گسترهی وسیعی از پدیدههای زیستی را تحت تأثیر قرار میدهد. در واقع، از دیرباز به عنوان نمونهی کلاسیک وراثت اپیژنتیکی شناخته شده است. با این حال، تحقیقات جدید نشان میدهد که این فرآیند بسیار پویاتر و پیچیدهتر از آن چیزی است که قبلاً تصور میشد.
کشف ۵-متیلسیتوزین در سلولهای زنده: آغاز یک قرن شگفتی
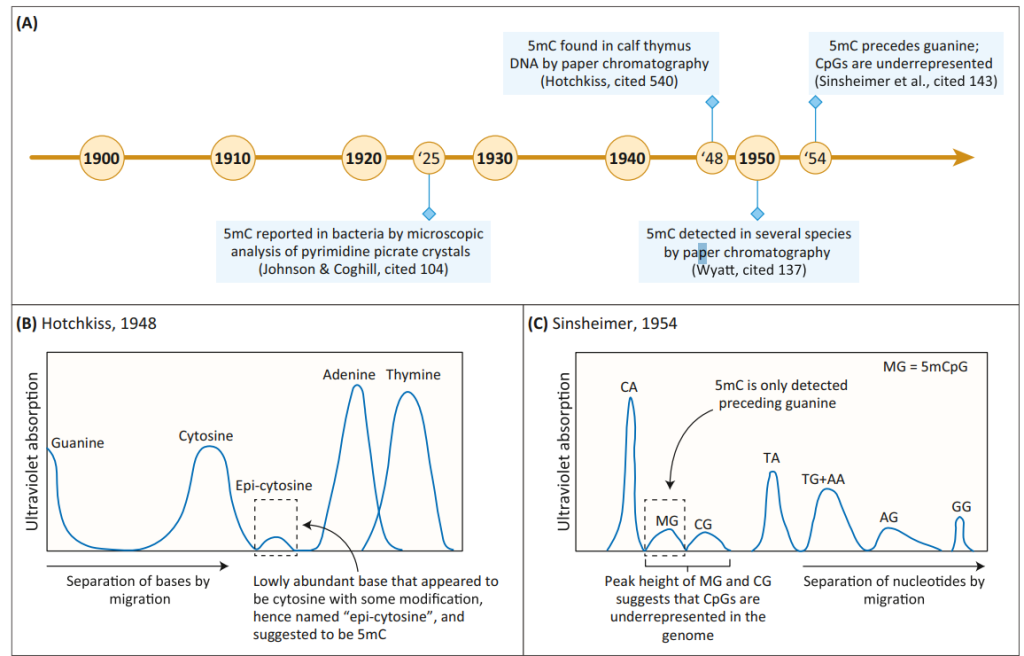
داستان کشف ۵-متیلسیتوزین (5mC)، یکی از پایههای علم اپیژنتیک، به سال ۱۹۲۵ بازمیگردد؛ زمانی که «جانسون» و «کاگهیل» در تلاش برای شناخت عامل بیماریزای Mycobacterium tuberculosis موفق به استخراج و تبلور اسیدهای نوکلئیک شدند.
یکی از ترکیبات مشکوک آنها، 5mC بود؛ نوکلئوتیدی که جانسون پیشتر در محیط آزمایشگاهی سنتز کرده بود و حدس میزد ممکن است بهصورت طبیعی در موجودات زنده نیز وجود داشته باشد. آنها با استفاده از نور قطبیده و میکروسکوپ، موفق شدند سیتوزین را از 5mC در بلورهای تجزیهشدهی اسید نوکلئیک جدا کنند. اما این کشف مهم برای مدتها بیپاسخ و بدون پیگیری ماند.بیش از دو دهه بعد، در سال ۱۹۴۸، «هاتچکیس» با استفاده از تکنیک نوین کروماتوگرافی کاغذی، نقطهای کمرنگ و نزدیک به سیتوزین را در DNA تیموس گوساله مشاهده کرد. این نقطه رفتاری مشابه سیتوزین داشت، اما کمی از آن فاصله گرفته بود. او این ترکیب را اپیسیتوزین نامید.
هاتچکیس متوجه شد همانطور که تیمین در ساختار با یوراسیل تفاوت دارد (زیرا تیمین یک متیلهشده از یوراسیل است)، احتمال دارد اپیسیتوزین نیز همان ۵-متیلسیتوزین باشد.دو سال بعد، «وایِت» وجود 5mC را در DNA موجودات پستاندار، گیاهان و حشرات با گسترهی وسیعی از مقادیر تأیید کرد. همزمان با کشف ساختار مارپیچ دوگانهی DNA و تأیید نقش اسیدهای نوکلئیک در انتقال اطلاعات ژنتیکی، توجه دانشمندان به متیلاسیون DNA نیز افزایش یافت.
نهایتاً «سینسهایمر» نشان داد که 5mC بهصورت تصادفی در ژنوم توزیع نشده، بلکه در بستر اختصاصی داینوکلئوتید CpG یافت میشود؛ نکتهای بسیار مهم در زمینهی تنظیم ژنها. جالبتر آنکه، نسبت مشاهدهی CpG در DNA یوکاریوتی کمتر از حد انتظار بود — پدیدهای که بعدها به ارتباط آن با متیلاسیون گسترده و خاموشی ژنها منجر شد.
متیلاسیون DNA در موجودات عالی: تنظیم ژنها از گذشته تا امروز
از باکتری تا انسان: آیا متیلاسیون نقش عمومی دارد؟
پس از کشف اینکه ۵-متیلسیتوزین (5mC) در باکتریها با وجود میزان کم خود، عملکردی زیستی دارد، احتمال اینکه متیلاسیون DNA بتواند نقش تنظیمی گستردهتری در میان گونههای مختلف ایفا کند، جدیتر شد. اما مانند بسیاری از حوزههای علمی، برای بررسی دقیق این فرضیه، نیاز به ابزارهای پیشرفتهتر و دادههای کمی بود. ورود فناوری طیفسنجی جرمی (mass spectrometry) در دهه ۱۹۷۰، امکان سنجش کمی دقیقتر سطح متیلاسیون در موجودات زنده را فراهم کرد.
دانشمندی به نام وانیوشین (Vanyushin) موفق شد سطوح 5mC را در سلولهای مختلف از جانورانی متنوع مانند اسفنجها، نرمتنان، توتیاهای دریایی، ماهیها، دوزیستان، خزندگان و پستانداران اندازهگیری کند. تحلیلهای او نشان داد که اگرچه محتوای GC و 5mC ممکن است بین گونهها تفاوت داشته باشد، اما معمولاً در گونههای نزدیکتر شباهت بیشتری وجود دارد. همچنین این مقادیر اغلب در بافتهای مختلف یک گونه نیز قابل مقایسهاند. جالبتر آنکه وانیوشین بعدها وجود 5mC را در توالیهایی غیر از CpG در گیاهان نیز گزارش داد، که نشاندهندهی تنوع بالای الگوهای متیلاسیون در دنیای گیاهی بود.
آیا متیلاسیون DNA نقشی در تنظیم ژنها دارد؟
با گسترش مطالعات و دادهها، دانشمندان مختلفی فرضیههایی درباره نقش متیلاسیون DNA در موجودات عالی مطرح کردند. از جمله این فرضیهها:
شاید 5mC نقشی در رشد و تکوین یوکاریوتها نداشته باشد.
ممکن است 5mC باعث جهشهای DNA شود، که در آن زمان تصور میشد برای تغییرات رونویسی لازماند.
برخی نیز گمان میکردند 5mC میتواند بهعنوان فعالکنندهی رونویسی عمل کند.
در سال ۱۹۷۵، سه بررسی مهم و بنیادین منتشر شدند که هر یک چارچوبی نظری برای درک عملکرد متیلاسیون DNA در تنظیم ژن ارائه دادند. با وجود تفاوت در جزئیات، همهی آنها یک پیام مشترک داشتند: متیلاسیون DNA، بهویژه 5mC، در کنترل بیان ژنها و مسیرهای تکوینی نقش دارد. کشف 5mC در گونههای مختلف و پیشرفت فناوری، زمینهساز آن شد که متیلاسیون DNA از یک پدیده شیمیایی ساده به یکی از ابزارهای کلیدی تنظیم ژن تبدیل شود. امروزه میدانیم این فرآیند نهتنها در رشد و تمایز سلولی، بلکه در بیماریهایی مانند سرطان، اختلالات مغزی و بیماریهای خودایمنی نیز نقش دارد.
چشمانداز متیلاسیون DNA در دهه ۲۰۰۰ تا ۲۰۰۹: از نقشههای ژنومی تا کشف مکانیسمهای تنظیمی
با ورود به دهه ۲۰۰۰، زیستشناسی مولکولی وارد عصری تازه شد. توالییابی کامل ژنومهایی مانند آرابیدوپسیس (Arabidopsis)، موش و انسان، افقهای جدیدی را برای مطالعه لایههای اپیژنتیکی باز کرد. اکنون دانشمندان میتوانستند فراتر از تنظیم ژنهای منفرد رفته و عملکردهای اپیژنتیکی را در مقیاس کل ژنوم بررسی کنند.
در نیمه دوم این دهه، ابزارهای محاسباتی پیشرفتهتر شدند و هزینه توالییابی کاهش یافت. روش بیسولفیت توالییابی (Bisulfite Sequencing)، که نخستین بار در سال ۱۹۹۲ معرفی شده بود، به استاندارد طلایی برای بررسی متیلاسیون DNA تبدیل شد. استفاده از این تکنیک، اولین نقشههای جامع متیلاسیون DNA (متیلوم) را در اختیار پژوهشگران قرار داد.
نقش متیلاسیون در تعاملات تقویتکننده–پروموتر (enhancer–promoter loops)
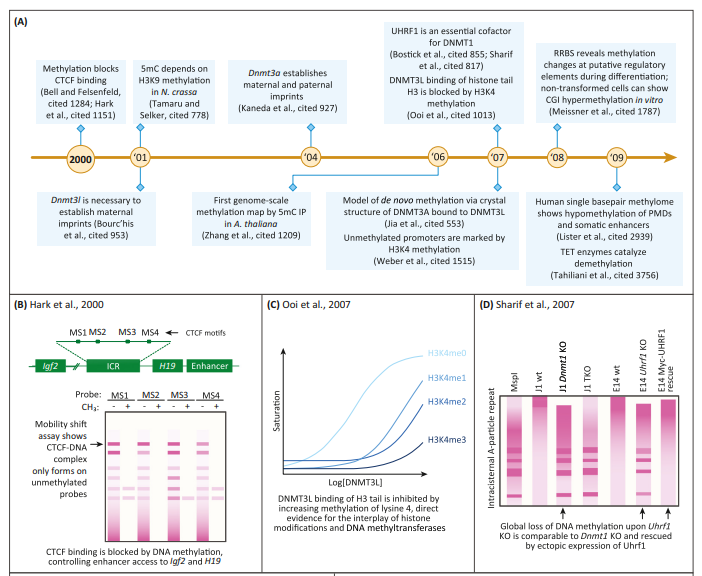
یکی از نقاط عطف مهم در این دوره، مطالعه بر روی بیان ژنهای Imprinted بود؛ ژنهایی که فقط یکی از نسخههای مادری یا پدری آنها فعال است. مثال کلاسیک آن ژنهای Igf2 و H19 هستند که به طور معکوس بیان میشوند، اما توسط یک ناحیه مشترک به نام Imprinting Control Region (ICR) تنظیم میشوند.
مطالعات نشان دادند که این ICR دارای ۴ جایگاه اتصال برای فاکتور CTCF است. زمانی که این جایگاهها متیله یا حذف میشوند، اتصال CTCF مختل شده و عملکرد بلوکهکننده تقویتکننده را از دست میدهد. به بیان دیگر، متیلاسیون این ناحیه تعیین میکند که تقویتکننده به کدام پروموتر (Igf2 یا H19) متصل شود. این یافتهها نشان دادند که متیلاسیون در خارج از پروموترها نیز میتواند نقش مهمی در تنظیم ساختار سهبعدی DNA و کنترل بیان ژن داشته باشد.
ارتباط میان متیلاسیون DNA و اصلاحات هیستونی
در سال ۲۰۰۱، Tamaru و Selker در قارچی به نام Neurospora crassa ژنی به نام dim-5 را شناسایی کردند که در متیلاسیون DNA نقش دارد. آنها دریافتند این ژن باعث متیلاسیون لایسین ۹ در هیستون ۳ (H3K9) میشود. هنگامی که این جایگاه با اسیدهای آمینه دیگری جایگزین شد، سطح متیلاسیون DNA کاهش یافت؛ این نشان میدهد که متیلاسیون H3K9 برای شروع متیلاسیون DNA ضروری است.
به دنبال این یافته، پژوهشگران در گیاه Arabidopsis نیز نشان دادند که آنزیم KRYPTONITE، که مسئول متیلاسیون H3K9 است، برای متیلاسیون نوع خاصی از توالیها توسط آنزیم CMT3 ضروری است. آنها همچنین دریافتند که LHP1، همسان پروتئین HP1 در حیوانات، با CMT3 تعامل دارد. این یافتهها پل ارتباطی مهمی میان اصلاحات هیستونی و متیلاسیون DNA در حیوانات و گیاهان برقرار کردند.
دهه ۲۰۰۰ را میتوان دوره طلایی در نقشهبرداری متیلاسیون ژنومی دانست. با ادغام روشهای نوین توالییابی، شناخت فزاینده از نقش اصلاحات هیستونی، و درک عمیقتری از مکانیسمهای اپیژنتیکی مانند متیلاسیون CTCF، زیستشناسان موفق شدند از درک ساده تنظیم ژنی، به ساختارهای پیچیدهای مانند لوپهای کروماتینی حساس به متیلاسیون برسند. این تحول زمینهساز درک بهتر از بیماریها، توسعه ابزارهای اپیژنتیکی، و حتی درمانهای نوین شد.
جهت مطالعه متیلاسون DNA چیست؟ (بخش دوم) کلیک کنید
منابع
Mattei, A. L., Bailly, N., & Meissner, A. (2022). DNA methylation: a historical perspective. Trends in Genetics, ۳۸(۷), ۶۷۶-۷۰۷
Smith, Z. D., Chan, M. M., Mikkelsen, T. S., Gu, H., Gnirke, A., Regev, A., & Meissner, A. (2012). A unique regulatory phase of DNA methylation in the early mammalian embryo. Nature, ۴۸۴(۷۳۹۴), ۳۳۹-۳۴۴.۴