ترانسفکشن، انواع و روشهای موجود- راهنمای فنی برای محققان زیستی (بخش ۲)

انواع اسید نوکلئیک در ترانسفکشن: بررسی تخصصی DNA
ترانسفکشن یکی از ابزارهای کلیدی در زیستشناسی مولکولی است که امکان وارد کردن ژنهای خارجی به سلولهای یوکاریوتی را فراهم میکند. یکی از رایجترین انواع اسید نوکلئئیک مورد استفاده در این فرآیند، DNA است. اما نحوه استفاده، نوع و ساختار DNA وارد شده به سلول، نقش مهمی در میزان موفقیت ترانسفکشن دارد. در این مقاله به بررسی انواع DNAهای قابل ترانسفکت شدن، ساختار پلاسمید، و تفاوت بین فرمهای مختلف آن میپردازیم.
ترانسفکشن پلاسمیدها؛ ناقلان محبوب DNA خارجی
در بیشتر ترانسفکشنها، DNA از طریق پلاسمیدها وارد سلول هدف میشود. پلاسمیدها ساختارهای حلقوی هستند که بخشهایی مانند:
پروموتر (مثلاً CMV یا EF-1a) برای شروع بیان ژن،
مبدأ همانندسازی برای تکثیر پلاسمید،
سایتهای آنزیمی چندگانه برای درج ژنهای خارجی (MCS)،
و نشانگر انتخابی مثل ژن مقاومت به آنتیبیوتیک را دارا هستند.
این ساختارها، پلاسمید را به یک ابزار قدرتمند برای بیان ژن خارجی در سلولهای یوکاریوتی تبدیل میکنند.
فرم DNA: حلقوی یا خطی؟
DNA پلاسمیدی میتواند به دو فرم حلقوی سوپرکویل یا خطیشده وارد سلول شود. اما کدام بهتر است؟
DNA سوپرکویل پایدارتر است و کمتر در معرض تخریب توسط اگزونوکلئازها قرار میگیرد؛ بنابراین بازدهی بالاتری در ترانسفکشن دارد.
در مقابل، DNA خطیشده تمایل بیشتری به ادغام در ژنوم سلول میزبان دارد و برای ترانسفکشن پایدار (Stable Transfection) مناسبتر است.
- بر خلاف تصور عمومی، استفاده از پلاسمید به معنای بیان دائمی ژن خارجی نیست. اگر DNA واردشده در ژنوم میزبان ادغام نشود، با تقسیم سلولی، ژن خارجی به تدریج از بین میرود.
مزایا و معایب پلاسمید نسبت به ناقلهای ویروسی
ترانسفکشن با پلاسمیدها در مقایسه با روشهای ویروسی مزایایی مانند:
✅ ایمنی بیشتر و عدم ریسک ادغام ناخواسته در ژنوم،
✅ کاهش پاسخ ایمنی در سلولها
را به همراه دارد.
اما در مقابل، راندمان پایینتر و تولید کمتر پروتئین هدف نسبت به وکتورهای ویروسی، از نقاط ضعف آن محسوب میشود.
ترانسفکشن RNA و mRNA: مسیری سریعتر به سوی بیان پروتئین هدف
در کنار DNA، RNA نیز یکی از مهمترین اسیدهای نوکلئیک مورد استفاده در ترانسفکشن است. استفاده از RNA، به ویژه پیامرسان (mRNA)، در سالهای اخیر توجه بسیاری از پژوهشگران حوزههای ژنتیک، زیستفناوری و داروسازی را به خود جلب کرده است.
ترانسفکشن RNA چیست؟
یکی از روشهای پرکاربرد در ورود مواد ژنتیکی به درون سلولهای یوکاریوتی، استفاده از ترکیبات شیمیایی است. این تکنیک، بدون نیاز به ویروس یا روشهای مکانیکی، با کمک مواد شیمیایی خاص فرآیند ترنسفکشن را تسهیل میکند.
دو نوع کلی ترنسفکشن شیمیایی
ترنسفکشن شیمیایی به طور کلی به دو دسته تقسیم میشود:
ترنسفکشن مبتنی بر لیپوزومها (Liposomal-based)
ترنسفکشن غیر لیپوزومی (Non-liposomal-based)
مانند DNA، RNA نیز میتواند از طریق ناقلهای ویروسی یا غیر ویروسی وارد سلولهای یوکاریوتی شود. اما تفاوت مهمی وجود دارد:
RNA نیازی به عبور از غشای هستهای ندارد؛ به همین دلیل، سرعت و کارایی ترانسفکشن RNA اغلب از DNA بیشتر است.
چرا mRNA؟ سرعت، ایمنی و کاربرد درمانی
استفاده از RNA پیامرسان (mRNA)، مسیری ایمنتر و سریعتر برای بیان ژن محسوب میشود.
برخلاف DNA، mRNA نیازی به ادغام در ژنوم سلول میزبان ندارد، بنابراین خطرات جهش ژنتیکی و تغییرات غیرقابل بازگشت در ژنوم کاهش مییابد.
پس از ورود به سیتوپلاسم، mRNA مستقیماً توسط ریبوزومها ترجمه میشود و بیان سریع پروتئین هدف را ممکن میسازد.
این ویژگیها باعث شدهاند که mRNA به عنوان یک پلتفرم بالقوه برای واکسنها و درمانهای ژنی نوین بهویژه در بیماریهای ویروسی و سرطان مطرح شود.
اما چرا همیشه از RNA استفاده نمیکنیم؟
علیرغم مزایای ذکر شده، ترانسفکشن RNA با چالشهایی نیز همراه است:
ناپایداری طبیعی RNA: RNA در مقایسه با DNA بسیار شکنندهتر است و هنگام انتقال داخل سلول به سرعت توسط آنزیمها (ریبونوکلئازها) تجزیه میشود.
بیان موقت: برخلاف DNA، که در صورت ادغام میتواند بیان ژن را پایدار کند، mRNA تنها برای مدت کوتاهی فعال میماند و نیاز به تکرار تزریق یا انتقال دارد.
انواع الیگونوکلئوتیدهای کوچک RNA و کاربرد آنها در ترانسفکشن
در حوزهی زیستفناوری، RNAهای کوچک یا Small RNAs نقش کلیدی در تنظیم بیان ژن دارند و به عنوان ابزارهای قدرتمند در مطالعات عملکرد ژنی و درمانهای نوین شناخته میشوند.
RNAهای کوچک، مولکولهایی با طول بین ۱۸ تا ۲۰۰ نوکلئوتید هستند که در تنظیم پسارونویسی و تغییرات RNA نقش دارند. انواع رایج آنها شامل:
miRNA (microRNA): تکرشتهای، تنظیمکننده بیان ژن با مهار ترجمه یا تخریب mRNA هدف
siRNA (small interfering RNA): دو رشتهای، برای خاموشسازی هدفمند یک ژن خاص
shRNA (short hairpin RNA): ساختار حلقهای، برای سکوت ژنها با تخریب mRNA
piRNA (piwi-interacting RNA): تکرشتهای، در مهار ترانسپوزونها و تنظیم پسارونویسی
انتخاب RNA مناسب وابسته به هدف آزمایش است.
اگر هدف شما خاموشسازی دقیق یک ژن خاص باشد، siRNA بهترین انتخاب است.
در صورتی که میخواهید چندین هدف را همزمان کنترل کنید، miRNAها عملکرد چندهدفه دارند.
با پیشرفتهای بیوتکنولوژی، امروزه میتوان RNAهای کوچک را به صورت الیگونوکلئیدهای مصنوعی سنتز کرد که در دو دسته قرار میگیرند:
مقلدها (Mimics): ساختارهایی مشابه miRNA یا siRNA که باعث سرکوب بیان ژن میشوند.
آنتاگونیستها (Antagonists): برای مهار عملکرد RNAهای کوچک خاص، مانند miRNA.
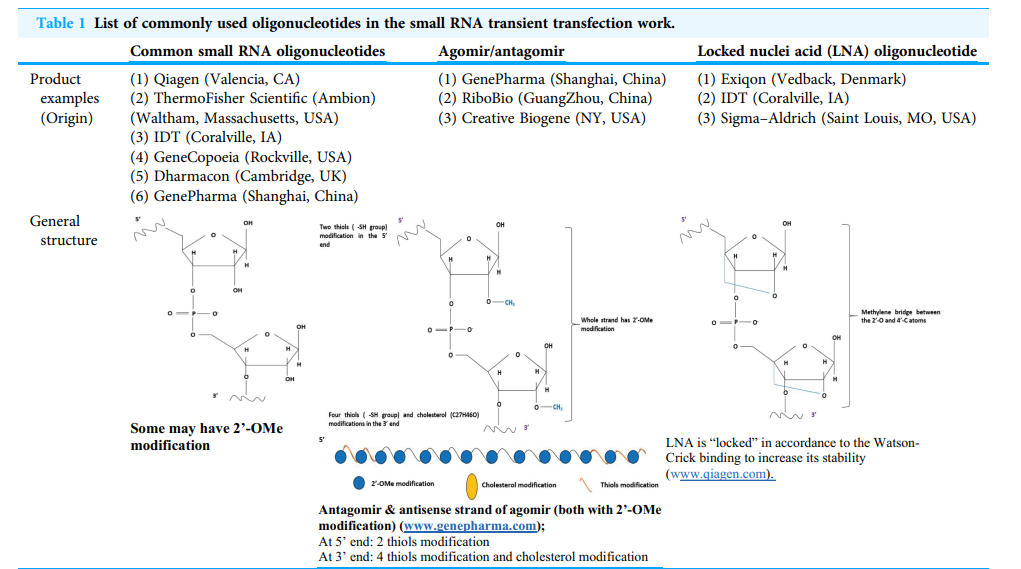
آگومیر و آنتاگومیر: نسل جدید الیگونوکلئوتیدها در فرایند ترانسفکشن
آگومیرها: نسخههای اصلاحشده و قویتر از miRNA mimics هستند که فعالیت مهاری بالاتری دارند.
آنتاگومیرها: رشتههای تکرشتهای اصلاحشده برای غیرفعالسازی خاص یک miRNA.
این ترکیبات با پایداری بالا، اثرگذاری بیشتر و نفوذ بهتر به سلول، انتخابی عالی برای مطالعات ژنی محسوب میشوند.
LNA (Locked Nucleic Acid) نوعی الیگونوکلئوتید است که با ایجاد یک پل متیلن در ساختار قند، پایداری آن را افزایش میدهد. مزایا:
پایداری بالا
نیاز نداشتن به ترانسفکشن ریجنت در برخی شرایط
اتصال قویتر به RNA هدف
مؤثر در آزمایشهای siRNA، miRNA و piRNA
الیگونوکلئوتیدهای RNA کوچک، از miRNA و siRNA گرفته تا آگومیر و LNA، نقش حیاتی در مهندسی ژنتیک، درمانهای هدفمند و تحقیقات عملکردی ایفا میکنند. انتخاب مناسب آنها بر اساس هدف آزمایش و شرایط ترانسفکشن، ضامن موفقیت مطالعات ژنتیکی خواهد بود.
ترانسفکشن ترکیبی چیست و چه کاربردهایی دارد؟
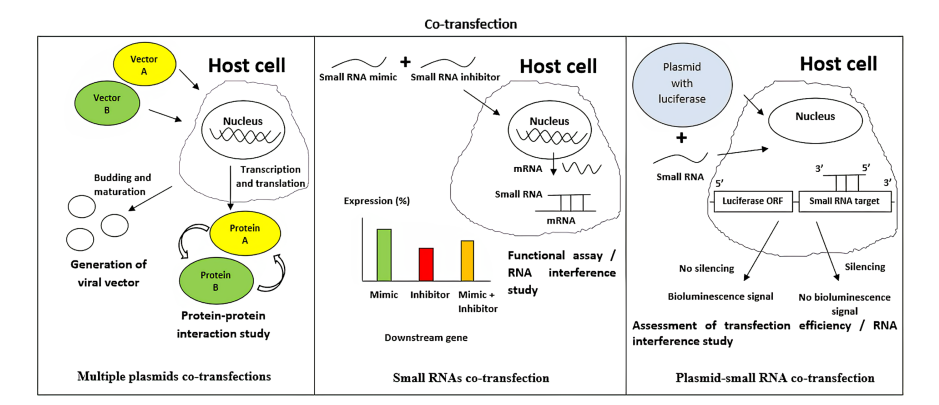
ترانسفکشن ترکیبی (Co-transfection) روشی پیشرفته در زیستفناوری است که در آن بیش از یک نوع اسید نوکلئیک (مانند DNA یا RNA) بهطور همزمان وارد سلولهای یوکاریوتی میشود. این روش در مطالعات عملکرد ژن، تعاملات پروتئینی و ویرایش ژنوم، جایگاهی ویژه دارد.
ترانسفکشن چندین پلاسمید DNA
برای انتقال همزمان چند ژن مختلف به سلول میزبان، تولید وکتورهای هیبریدی (مانند لنتیویروسها)، یا بررسی تعامل پروتئینها با یکدیگر (PPI) بهکار میرود. در چنین مطالعاتی، کاهش یا افزایش فعالیت یک پروتئین بر اساس اندازهگیری بیولومینسانس (مانند BRET) انجام میشود.ترانسفکشن همزمان siRNA و پلاسمید DNA
این روش برای بررسی عملکرد ژن یا میزان کارایی ترانسفکشن استفاده میشود. برای مثال، یک پلاسمید شامل ژن گزارشگر لوسیفراز و یک siRNA هدف وارد سلول میشوند؛ اگر siRNA موفق به سرکوب ژن شود، فعالیت لوسیفراز کاهش مییابد و این تغییر قابل اندازهگیری است.ترانسفکشن چندین miRNA یا RNA کوچک غیرکدکننده
این تکنیک برای مطالعهی اثرات همزمان چند RNA کوچک روی بیان ژنهای هدف بهکار میرود. بهعنوان مثال، ترکیب یک میمیک miRNA با آنتاگونیست آن در یک سلول میتواند تنظیم بیان ژن هدف را بررسی کند.
اهمیت ترانسفکشن ترکیبی در مطالعات زیستی
بررسی دقیقتر تنظیم بیان ژنها
با ترکیب چند نوع RNA یا DNA، پژوهشگران میتوانند اثرات همافزایی یا تضعیفکنندهی ژنها را درک کنند.کاربرد در ویرایش ژنوم (CRISPR-Cas9)
کوترانسفکشن پلاسمید حاوی پروتئین Cas9 و gRNA برای ایجاد تغییرات هدفمند در DNA سلول بسیار کاربردی است.تحقیقات در بیماریها و ژندرمانی
امکان بررسی همزمان چند مسیر مولکولی مرتبط با بیماریها را فراهم میکند.ترانسفکشن ترکیبی ابزاری ارزشمند در پژوهشهای سلولی و مولکولی است. از تولید وکتورهای پیچیده گرفته تا تحلیل دقیق تنظیمات ژنی، این تکنیک دانشمندان را قادر میسازد تا با دقت و عمق بیشتری به بررسی مکانیسمهای بیولوژیکی بپردازند.
کنترلهای حیاتی در آزمایش ترانسفکشن: چرا و چگونه؟
یکی از مراحل حیاتی و غیرقابل چشمپوشی در طراحی آزمایشهای ترانسفکشن، استفاده از کنترلهای مناسب برای اطمینان از اعتبار نتایج بهدستآمده است. بدون وجود کنترلهای دقیق، امکان تحلیل صحیح از کارایی ترانسفکشن، تاثیر مواد مورد استفاده و عملکرد دقیق اسیدهای نوکلئیک وجود ندارد. بنابراین، شناخت دقیق انواع کنترلهایی که باید در آزمایشات ترانسفکشن بهکار روند، برای پژوهشگران ضروری است.
کنترل مثبت (Positive Control)
کنترل مثبت در آزمایش ترانسفکشن، نقش معیار استاندارد را ایفا میکند. این کنترل شامل یک DNA یا RNA است که پیشتر اثر آن در تغییر بیان ژن یا عملکرد خاصی تأیید شده است. برای مثال، اگر قرار است بررسی شود که یک RNA خاص باعث خاموشی یک ژن میشود، کنترل مثبت RNAیی است که قبلاً این عملکرد را نشان داده است. وجود این کنترل به پژوهشگر کمک میکند تا از صحت اجرای مراحل و کارایی کلی سیستم ترانسفکشن مطمئن شود، بهخصوص در مراحل اولیه تنظیم و بهینهسازی پروتکل آزمایش.
کنترل منفی (Negative Control)
کنترل منفی تضمین میکند که تغییرات مشاهدهشده واقعاً ناشی از ترانسفکشن هستند و نه عوامل دیگر. در ترانسفکشن DNA، کنترل منفی میتواند شامل واکنشی باشد که فاقد DNA یا ناقل انتقال (Carrier) باشد. در ترانسفکشن RNA، معمولاً از سکانسهای Scrambled استفاده میشود، که از نظر طول و ترکیب نوکلئوتیدی مشابه RNA هدف هستند، اما هیچ شباهتی به ژنهای شناختهشده پستانداران ندارند. این کار کمک میکند تا اثرات غیراختصاصی شناسایی و حذف شوند.
کنترل بدون ترانسفکشن (Untransfected Control)
این نوع کنترل شامل سلولهایی است که هیچگونه ماده ژنتیکی یا عامل انتقال به آنها وارد نشده است. اطلاعات بهدستآمده از این گروه شامل سطح پایه بیان ژن هدف، زندهمانی سلول، مورفولوژی و سایر مشخصات پایه است. این گروه نقش مهمی در شناسایی تغییرات ایجادشده بر اثر فرآیند ترانسفکشن ایفا میکند.
کنترل Mock یا پلاسمید خالی (Mock Transfection)
در این کنترل، عمل ترانسفکشن انجام میشود، اما هیچ ماده ژنتیکی وارد نمیشود. برای نمونه، تنها از ناقل پلاسمیدی فاقد ژن هدف استفاده میشود (پلاسمید خالی). هدف از این نوع کنترل بررسی اثرات احتمالی ناشی از مواد واسطه انتقال یا پسزمینه فلورسانس است که ممکن است در تفسیر نتایج تداخل ایجاد کند. استفاده از پلاسمید خالی بهعنوان کنترل Mock در آزمایشات پلاسمیدی توصیه میشود.
بقیه تکنیک ها را مطالعه کنید

الکتروفورز دوبعدی: ابزاری قدرتمند برای تفکیک پروتئینها
الکتروفورز دوبعدی: ابزاری قدرتمند برای تفکیک پروتئینها الکتروفورز دوبعدی تکنیکی قدرتمند برای تشخیص و تحلیل پروتئینها است که آنها را بر اساس دو ویژگی متفاوت از یکدیگر تفکیک میکند. الکتروفورز دوبعدی با ترکیب دو تکنیک متمرکزسازی ایزوالکتریک (IEF) و الکتروفورز

راهنمای اصول کشت سلولی – بخش ۱
موضوعاتی مانند آشنایی با الزامات آزمایشگاه اختصاصی برای آزمایشهای کشت سلولی، ایمنی آزمایشگاهی، تکنیکهای آسپتیک، و آلودگیهای میکروبی در کشتهای سلولی را پوشش میدهند. همچنین روشهای پایه برای پاساژ، انجماد،

انواع و روشهای ترنسفکشن: راهنمای فنی برای محققان زیستی (بخش ۲)
ترانسفکشن یکی از ابزارهای کلیدی در زیستشناسی مولکولی است که امکان وارد کردن ژنهای خارجی به سلولهای یوکاریوتی را فراهم میکند. یکی از رایجترین انواع اسید نوکلئئیک مورد استفاده در این فرآیند، DNA است.

آموزش جامع تکنیک ژل الکتروفورز: تکنیکی کلیدی در زیستشناسی مولکولی
ژل الکتروفورز یکی از تکنیکهای بنیادین و پرکاربرد در زیستشناسی مولکولی، بیوتکنولوژی و پزشکی است که برای جداسازی مولکولهای زیستی مانند اسیدهای نوکلئیک و پروتئینها بر اساس ویژگیهای فیزیکی نظیر اندازه،
