اپی ژنتیک چیست؟
اپی ژنتیک چیست؟ نقش آن در سلامت، بیماری و درمانهای نوین
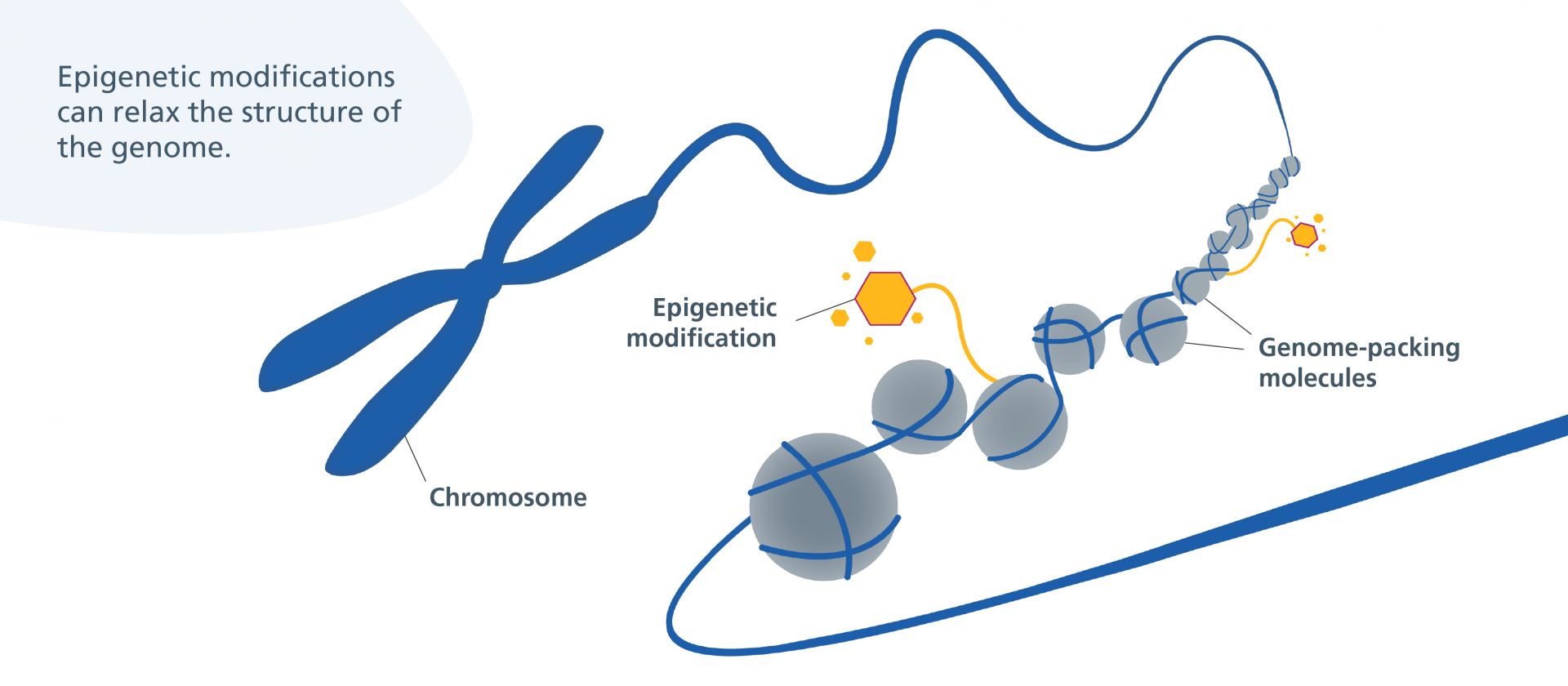
اپی ژنتیک چیست؟ به زبان ساده، اپیژنتیک به مطالعه تغییرات قابلوراثتی در بیان ژنها اشاره دارد که بدون تغییر در توالی DNA رخ میدهند. این فرآیند از مراحل اولیه رشد جنین تا پایان عمر انسان نقش کلیدی در تنظیم عملکرد سلولها، تمایز سلولی، پاسخ به محیط و حتی بیماریها ایفا میکند. اپیژنتیک مانند یک تنظیمکننده ژن عمل میکند که تعیین میکند کدام ژنها فعال یا غیرفعال شوند. مکانیزمهای اصلی اپیژنتیک شامل متیلاسیون DNA، تغییرات هیستونی و نقش RNAهای غیرکدکننده هستند که با همکاری یکدیگر ساختار کروماتین و سازماندهی ژنومی را شکل میدهند.
این تغییرات اپیژنتیکی نهتنها در لحظه تأثیر دارند، بلکه اثرات بلندمدتی در فرآیندهایی مانند یادگیری، حافظه، و حتی بیماریهایی مثل سرطان و اختلالات عصبی دارند. برخلاف جهشهای ژنتیکی که دائمی هستند، تغییرات اپیژنتیکی قابلبرگشتاند و این ویژگی آنها را به هدفی جذاب برای درمانهای نوین تبدیل کرده است. در این مقاله، به بررسی دقیقتر اپیژنتیک، مکانیزمهای آن و کاربردهایش در سلامت و درمان میپردازیم.
اپی ژنتیک چیست و چگونه کار میکند؟
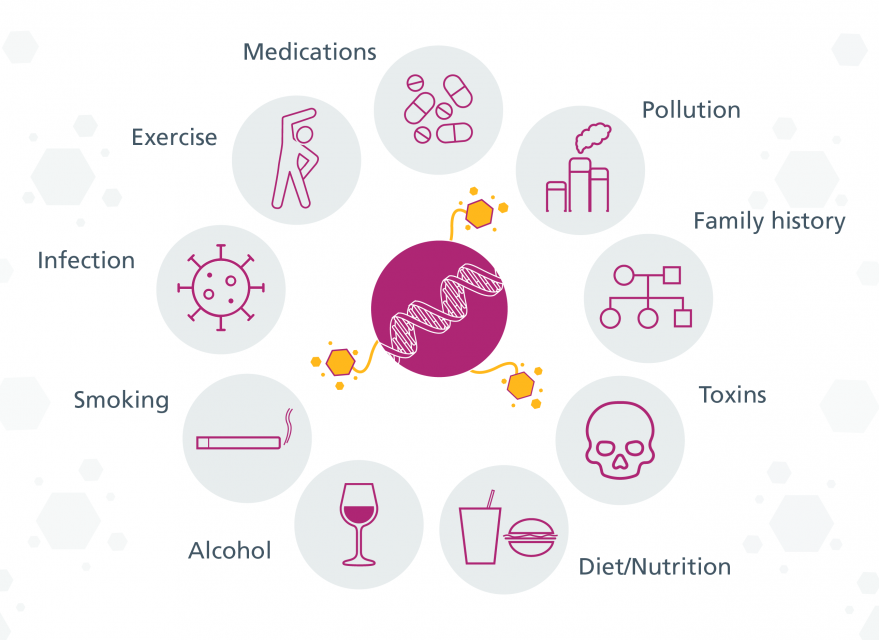
اپیژنتیک به معنای «فراتر از ژنتیک» است و به فرآیندهایی اشاره دارد که بیان ژنها را بدون تغییر در کد ژنتیکی تنظیم میکنند. این تغییرات میتوانند از نسلی به نسل دیگر منتقل شوند و در عین حال به محرکهای محیطی مانند رژیم غذایی، استرس، یا مواد شیمیایی پاسخ دهند. برای مثال، غیرفعالسازی کروموزوم X در زنان یا نشانهگذاری میتوزی از جمله فرآیندهای اپیژنتیکی هستند که ویژگیهای ارثی پایدار ایجاد میکنند. همچنین، تغییراتی مانند فسفریلاسیون هیستونها به سلولها امکان میدهند تا بهسرعت به استرسها و محرکهای محیطی واکنش نشان دهند.
متیلاسیون DNA: مکانیزم کلیدی در اپیژنتیک
متیلاسیون DNA یکی از مهمترین مکانیزمهای اپیژنتیکی است که با خاموش کردن ژنها و حفظ پایداری ژنومی ارتباط مستقیم دارد. این فرآیند معمولاً در توالیهای CpG (مناطقی که سیتوزین در کنار گوانین قرار دارد) رخ میدهد. حدود ۱ تا ۲ درصد از ژنوم انسان شامل جزایر CpG است که در نزدیکی پروموترهای ژنها قرار دارند و معمولاً از متیلاسیون در امان میمانند. با این حال، متیلاسیون غیرطبیعی در این نواحی میتواند منجر به بیماریهایی مانند سرطان شود.
تحقیقات نشان دادهاند که متیلاسیون DNA توسط آنزیمهایی مانند DNMT1، DNMT3a و DNMT3b تنظیم میشود. این آنزیمها در مراحل مختلف رشد و در سلولهای سوماتیک نقش دارند. برای مثال، DNMT1 در چنگالهای همانندسازی DNA فعال است و الگوهای متیلاسیون را حفظ میکند. در مقابل، شواهد جدید نشان میدهند که فرآیند دمتیلاسیون فعال میتواند در شکلگیری حافظه بلندمدت در نورونهای بزرگسال نقش داشته باشد.
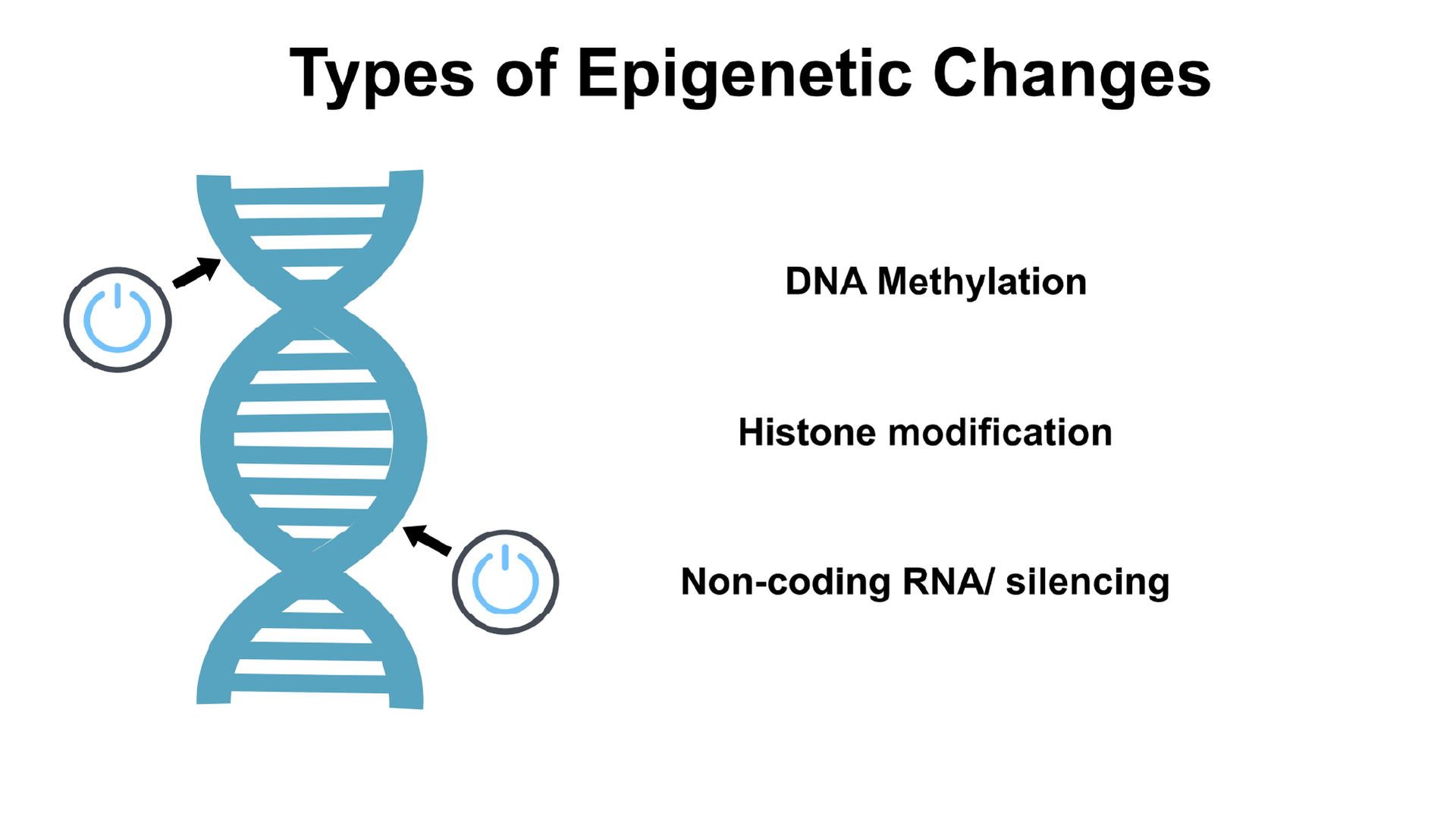
نقش RNAهای غیرکدکننده در اپیژنتیک
تقریباً نیمی از جزایر CpG به پروموترهای شناختهشده متصل نیستند و در نواحی بینژنی یا درونژنی قرار دارند. این نواحی میتوانند آغازگر رونویسی RNAهای غیرکدکننده مانند miRNAها باشند. مطالعات نشان دادهاند که الگوهای غیرطبیعی متیلاسیون در تومورها با بیان غیرعادی miRNAها مرتبط است. برای مثال، در کروموزوم X فعال، نواحی پروموتر معمولاً هیپومتیلاسیون و بدنه ژنها هایپرمتیلاسیون را تجربه میکنند. این تغییرات اپیژنتیکی نقش مهمی در تنظیم ژنها و پیشرفت بیماریهایی مانند سرطان دارند.
تغییرات هیستونی: تنظیمکنندههای اصلی ژنها
تغییرات هیستونی یکی دیگر از مکانیزمهای کلیدی اپیژنتیک هستند که در تنظیم بیان ژنها، ساختار کروماتین و عملکرد سلولی نقش دارند. هیستونها پروتئینهایی هستند که DNA را در کروماتین سازماندهی میکنند. تغییرات پسترجمهای هیستونها شامل موارد زیر است:
- متیلاسیون هیستونها: بسته به موقعیت و تعداد گروههای متیل، میتواند ژنها را فعال یا غیرفعال کند.
- استیلاسیون هیستونها: معمولاً با فعالسازی ژنها مرتبط است و کروماتین را باز میکند.
- فسفریلاسیون هیستونها: در پاسخ به آسیب DNA یا تنظیم چرخه سلولی نقش دارد.
- یوبیکوئیتیناسیون هیستونها: در پایداری هیستونها و فرآیندهای دیگر دخیل است.
پروتئینهای متصل به متیلسیپیجی (MBDs) با کمپلکسهای سرکوبگر مانند هیستون داستیلازها (HDACs) همکاری میکنند تا کروماتین را متراکم کرده و بیان ژنها را سرکوب کنند. برای مثال، در سلولهای سرطانی سینه، پروموتر ژن TFF1 بهطور فعال دچار متیلاسیون و دمتیلاسیون میشود که توسط پروتئینهایی مانند MeCP2 و DNMT3a/b تنظیم میشود.
کاربرد اپیژنتیک در درمانهای نوین
یکی از جذابترین جنبههای اپیژنتیک، قابلیت برگشتپذیری تغییرات آن است. برخلاف جهشهای ژنتیکی، تغییرات اپیژنتیکی میتوانند با استفاده از داروها یا فناوریهای جدید مانند کریسپر اصلاح شوند. برای مثال، تحقیقات روی سندروم رت نشان دادهاند که پروتئین MeCP2 در نورونها نقش حیاتی دارد و اصلاح آن میتواند به درمان این اختلال کمک کند. همچنین، مهارکنندههای HDAC و داروهای دمتیلکننده DNA در درمان سرطانهای مختلف نتایج امیدوارکنندهای نشان دادهاند.
اپیژنتیک و حافظه بلندمدت
مطالعات جدید نشان دادهاند که تغییرات سریع در متیلاسیون و دمتیلاسیون DNA در نورونهای بزرگسال نقش مهمی در تشکیل حافظه بلندمدت دارند. این فرآیندها توسط آنزیمهایی مانند thymine DNA glycosylase و پروتئینهای ترمیم برش بازی (BER) تنظیم میشوند. این یافتهها نشان میدهند که اپیژنتیک نهتنها در بیماریها، بلکه در عملکردهای شناختی نیز نقش کلیدی دارد.
