الکتروفورز دوبعدی: ابزاری قدرتمند برای تفکیک پروتئینها

الکتروفورز دوبعدی تکنیکی قدرتمند برای تشخیص و تحلیل پروتئینها است که آنها را بر اساس دو ویژگی متفاوت از یکدیگر تفکیک میکند. الکتروفورز دوبعدی با ترکیب دو تکنیک متمرکزسازی ایزوالکتریک (IEF) و الکتروفورز ژل پلیآکریلآمید (SDS-PAGE) امکان جداسازی دقیق پروتئینها را فراهم میکند. این ترکیب باعث میشود تا هزاران پروتئین بهصورت همزمان با وضوح بالا تحلیل شوند. پروتئینها در مرحله اول (IEF) بر اساس نقطه ایزوالکتریک و در مرحله دوم (SDS-PAGE) بر اساس وزن مولکولی از یکدیگر جدا میشوند. در این مقاله چیستی الکتروفورز دوبعدی، کاربرهای این روش، مراحل انجام تکنیک و مزایا و معایب آن بررسی میشوند.
الکتروفورز دوبعدی چیست و چگونه کار میکند؟
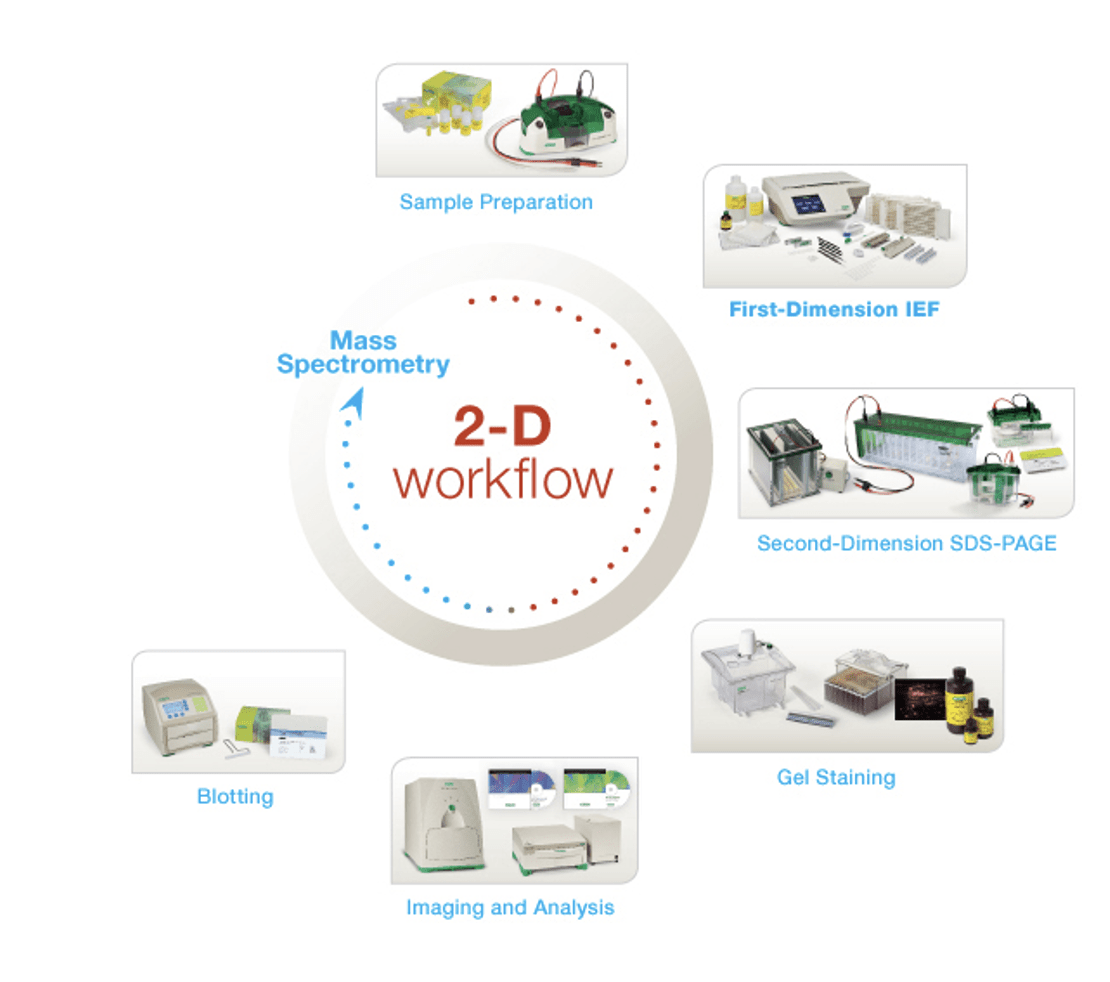
روشهای الکتروفورز پروتئینی یکبعدی مانند SDS-PAGE بهطور معمول در آزمایشگاه اجرا میشوند، اما این روشها توانایی تفکیک محدودی دارند. الکتروفورز دوبعدی ژل (۲-DE) پروتئینها را در نمونههای پیچیده بر اساس مقدار نقطه ایزوالکتریک (pI) و وزن مولکولی جدا میکند و امکان مقایسه مستقیم صدها یا هزاران پروتئین بهطور همزمان با وضوح بالا را فراهم میسازد. زمانی که این روش با نرمافزارهای تحلیلی، روشهای ایمنیشناسی یا تکنیکهای طیفسنجی جرمی ترکیب شود به ابزاری قدرتمند برای شناسایی پروتئینها و سایر تحلیلهای پروتئومیک تبدیل میشود.
چرا از الکتروفورز دوبعدی استفاده میکنیم؟
این تکنیک در حوزههای مختلف علمی کاربردهای گستردهای دارد:
- تحلیل پروتئوم، اصلاحات و تعاملات پروتئینی
- پژوهشهای سرطان، شناسایی بیومارکرها و نشانگرهای بیماری
- مطالعه بیماریزایی باکتریایی و واکنشهای سلولی
- کشف دارو، خالصسازی پروتئین در مقیاس میکرو و مشخصهیابی محصولات
تشخیص پروتئین
الکتروفورز ژل دوبعدی بهطور گسترده برای شناسایی تغییرات در سطح بیان پروتئینها که در اثر بیماریها یا مداخلات دارویی ایجاد میشود، کاربرد دارد. این تکنیک ابزاری ارزشمند برای مطالعه تغییرات پس از ترجمه، مانند اکسیداسیون یا فسفریلاسیون و شناسایی ایزوفرمهای پروتئینی محسوب میشود. حتی تغییرات جزئی در جرم مولکولی یا نقطه ایزوالکتریک پروتئینها باعث تغییر در الگوهای پروتئینی مشاهدهشده در الکتروفورز ژل دوبعدی میشود.
تحلیل پروتئین
الکتروفورز ژل دوبعدی روشی قدرتمند برای جداسازی هزاران پروتئین بهصورت همزمان است و به همین دلیل، یکی از روشهای برجسته برای تحلیل مخلوطهای پیچیده پروتئینی محسوب میشود. این تکنیک امکان بررسی بصری تغییرات در فراوانی پروتئینها و اصلاحات پس از ترجمه (PTM) را فراهم میکند و در مراحل اولیه، اعتبارسنجی اطلاعات لازم برای تحلیلهای بعدی را ارائه میدهد که حتی از طریق توالییابی ژنومی قابل پیشبینی نیستند.
مراحل انجام تکنیک الکتروفورز دوبعدی شامل چیست؟
فرایند انجام تکنیک ۲-DE شامل مراحلی است که در ادامه شرح داده شده است.
۱.آمادهسازی نمونه
روشهای آمادهسازی نمونه از استخراج با محلولهای ساده حلکننده تا استفاده از ترکیبات پیچیده مانند عوامل کائوتروپیک، شویندهها و عوامل احیاکننده متغیر هستند. این مرحله میتواند شامل غنیسازی یا جداسازی مخلوطهای پروتئینی برای کاهش پیچیدگی نمونه باشد. در هر حال استراتژی آمادهسازی نمونه متفاوت و وابسته به نوع نمونه و هدف انجام آزمایش متفاوت است.
۲.بُعد اول الکتروفورز
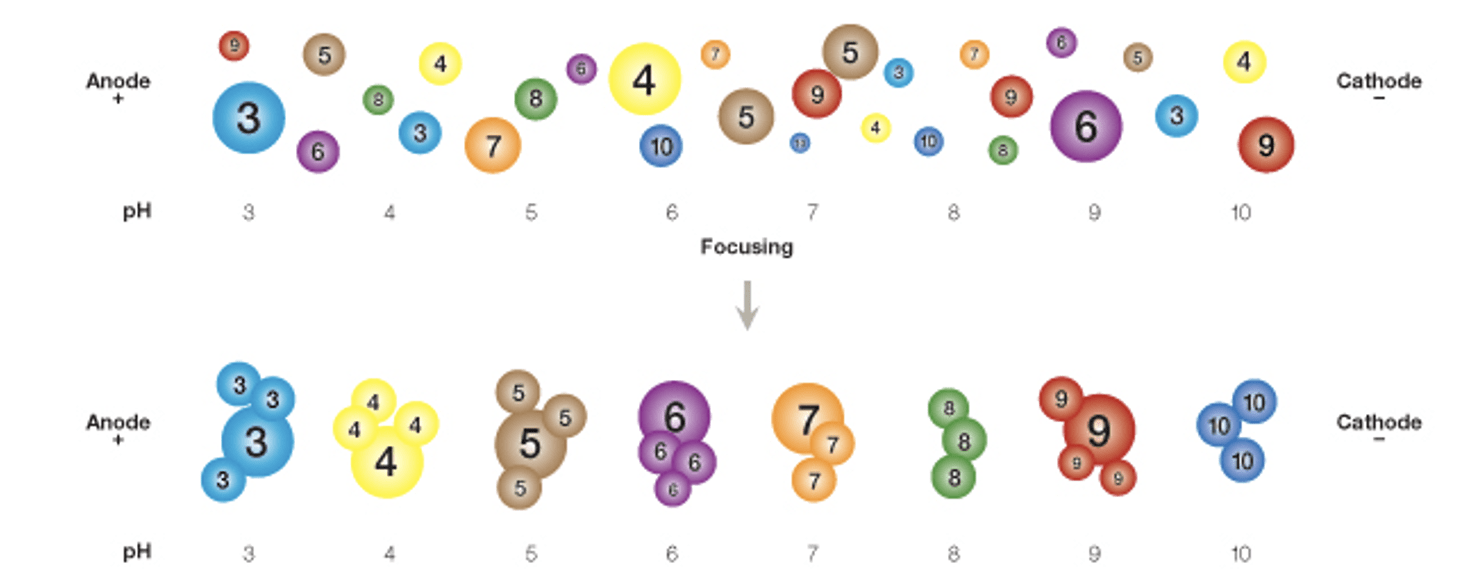
بعد اول شامل جداسازی پروتئینها بر اساس نقطه ایزوالکتریک آنها از طریق متمرکزسازی ایزوالکتریک (IEF) است. IEF با اعمال یک میدان الکتریکی بر پروتئین در یک شیب pH کار میکند. پروتئینها در پاسخ به ولتاژ اعمالشده در طول شیب pH حرکت کرده و جدا میشوند. زمانی که پروتئین به مقدار pH معادلی با pI خود برسد، بار الکتریکی خالص آن خنثی شده و از حرکت بازمیایستد. به این ترتیب، هر پروتئین در نمونه بر اساس pI خود “متمرکز” میشود.
مطالعه آموزش جامع تکنیک ژل الکتروفورز: تکنیکی کلیدی در زیستشناسی مولکولی در تیوان ژن

IEF
زمانی که یک پروتئین در محیطی با شیب pH قرار گرفته و در معرض یک میدان الکتریکی قرار میگیرد، ابتدا به سمت الکترودی که بار مخالف دارد حرکت میکند. در طی مهاجرت در شیب pH، پروتئین ممکن است پروتون جذب کند یا از دست بدهد. با ادامه حرکت، بار خالص و تحرک آن کاهش یافته و سرعت حرکت پروتئین کم میشود. در نهایت، پروتئین به نقطهای میرسد که در آن مقدار pH برابر با pI آن است. در این حالت، چون بار الکتریکی آن خنثی شده است، حرکت آن متوقف میشود.
اگر پروتئین بهصورت تصادفی به ناحیهای با pH پایینتر منتشر شود، پروتوندار شده و تحت تأثیر میدان الکتریکی به سمت کاتد بازمیگردد. در مقابل، اگر به ناحیهای با pH بیشتر از pI خود منتشر شود، بار منفی پیدا کرده و به سمت آند حرکت خواهد کرد. به این ترتیب، پروتئینها در شیب pH در مقادیر مشخص pI خود متراکم و متمرکز میشوند و باندهای واضحی را تشکیل میدهند.
تمرکز ایزوالکتریک (IEF) یک مکانیزم تعادلی نسبت به pH است. پروتئینها با سرعتهای متفاوتی به مقدار pI خود نزدیک میشوند اما برای مدت طولانی در همان مقادیر pH باقی میمانند و از هر نقطهای در سیستم به موقعیت تعادلی خود مهاجرت میکنند. در مقابل، پروتئینها در الکتروفورز معمولی تا زمانی که میدان الکتریکی حذف نشود، به حرکت خود ادامه میدهند.
روشهای ایجاد شیب pH
IEF را میتوان با دو روش انجام داد؛ شیبهای pH تثبیتشده (IPG) که در آن آمفولیتها بهطور کووالانسی به ژل متصل شدهاند یا آمفولیتهای حامل که در ژل حرکت کرده و شیب pH را ایجاد میکنند.
۱. carrier ampholyte gels
ژلهای آمفولیت حامل، نوعی ژل مورد استفاده درمتمرکزسازی ایزوالکتریک هستند که شامل مخلوطی از مولکولهای آمفولیت با وزن مولکولی پایین هستند. این آمفولیتها دارای بارهای مثبت و منفی هستند و در حضور یک میدان الکتریکی، یک شیب pH خطی و پایدار را در ژل ایجاد میکنند. برخلاف نوارهای IPG که دارای شیب pH تثبیتشده هستند، آمفولیتهای حامل در ژل حرکت کرده و شیب pH را بهصورت پویا ایجاد میکنند.
۲. IPG Strips
نوارهایی با شیب pH تثبیت شده strips) (IPG بهصورت تجاری عرضه میشوند، استفاده آسانی دارند و طی دورههای طولانی متمرکزسازی ایزوالکتریک، شیبهای پایدار و قابلتکرار ارائه میدهند. این نوارها روی یک لایه پلاستیکی قرار دارند و میتوان آنها را در دمای ۲۰- درجه سانتیگراد بهطور نامحدود ذخیره کرد بدون اینکه الگوی نهایی دوبعدی تحت تأثیر قرار گیرد. طول IPG stripها عمدتاً به اندازه ژلهای بعد دوم وابسته است و در اندازههای ۷ تا ۲۴ سانتیمتری وجود دارد. IPG stripهای بلندتر و ژلهای بزرگتر ظرفیت نمونه بیشتری را فراهم کرده و وضوح بالاتری ارائه میدهند.

شیبهای pH در نوارهای IPG با مجموعهای از بافرهای آکریلامیدی ایجاد میشوند، که مشتقاتی از آکریلآمید هستند و شامل پیوندهای دوگانه واکنشپذیر و گروههای بافری هستند. ساختار کلی آنها به صورت CH₂=CH–CO–NH–R است. R میتواند یک گروه کربوکسیل (–COOH) یا یک گروه آمین نوع سوم مثل –N(CH₃)₂ باشد. این مشتقات آکریلآمید بهصورت کووالانسی در ژلهای پلیآکریلآمید هنگام آمادهسازی ژل وارد شده و امکان ایجاد تقریباً هر شیب pH ممکن را فراهم میکنند.
آمادهسازی strip IPGها و بارگذاری نمونهها
IPG stripها در ابتدا آبگیری شده هستند و باید قبل از استفاده در سینی مخصوص مجدداً هیدراته شوند تا به ضخامت اصلی خود برسند. انتخاب بافر مورد استفاده برای عمل هیدراته کردن با توجه به شرایط میتواند متفاوت باشد، اما به طور معمول حاوی اوره (دناتورهکننده و حلکننده پروتئینها)، شویندۀ غیریونی یا زوئیترونی همانند CHAPS (حلکننده پروتئینهای آبگریز و کاهشدهنده تجمع پروتئینها)، معرف احیا کننده به نام DTT، رنگ (نشانهای برای دنبال کردن نحوه پیشرفت IEF) و بافر IPG یا فارمالیتهای متناسب با محدوده pH نوار IPG است و توسط تولید کنندگان IPG در جداولی از قبل تهیه شده توصیه میشود. برای افزایش حلالیت نمونه میتوان علاوه بر اوره از تیواوره استفاده کرد.
روش مناسب برای بارگذاری نمونه بسته به نوع نمونه و نیاز آزمایش انتخاب میشود. سه روش بارگذاری نمونه وجود دارد که به شرح زیر است:
۱. هیدراتهسازی غیرفعال همراه با نمونه: در این روش، نوارها با محلول حاوی نمونه هیدراته میشوند و پروتئینها به آرامی جذب ژل میشوند.
۲. هیدراتهسازی فعال همراه با نمونه: یک ولتاژ بسیار کم اعمال میشود تا ورود پروتئینها به ژل سریعتر شود. پروتئینها نهتنها از طریق جذب وارد ژل میشوند، بلکه تحت جریان الکتریکی نیز حرکت میکنند. این روش برای پروتئینهای بزرگ مفید است و پروتئینهای کوچک با تحرک بالاتر ممکن است از نوار خارج شوند و از دست بروند.
۳. بارگذاری نمونه از طریق cup loading: در این روش، ابتدا نوارهای IPG هیدراته میشوند، سپس نمونه از طریق cupهای مخصوص و تحت جریان الکتریکی وارد ژل میشود. این روش بیشتر برای نمونههایی با ترکیبات خاص مانند DNA، RNA یا گلیکوپروتئینها مفید است. روش امکان بارگذاری نمونههای خاص را فراهم میکند و در برخی موارد، عملکرد بهتری نسبت به روشهای دیگر دارد.
تأثیر طول نوارهای IPG
- v اگر دو نوار IPG دارای محدوده pH یکسان باشند ولی طولشان متفاوت باشد:
نوار بلندتر وضوح بهتری دارد، چون پروتئینها فضای بیشتری برای حرکت و تمرکز دارند. برای مثال، نوار ۱۱ سانتیمتری نسبت به نوار ۷ سانتیمتری با همان pH، ۱.۶ برابر بهتر متمرکزسازی را انجام میدهد (چون ۱۱ را تقسیم بر ۷ میکنیم).
- v اگر دو نوار IPG دارای طول یکسان باشند ولی محدوده pH متفاوت داشته باشند :
نوار با محدوده pH کوچکتر وضوح بیشتری دارد، چون پروتئینها در یک بازه pH محدودتر توزیع میشوند و بهتر در نقاط ایزوالکتریک خود قرار میگیرند. برای مثال، نوار pH ۵ تا ۸ نسبت به نوار pH ۳ تا۱۰ وضوح ۲.۳ برابر بیشتر دارد (چون ۷ واحد pH را تقسیم بر ۳ واحد pH میکنیم).
تاثیر محدوده شیب pH نوارهای IPG
استفاده از strip IPGها با دامنه گسترده (pH 3–۱۰) امکان نمایش بیشتر پروتئینها را در یک ژل واحد فراهم میکند. با بهکارگیری نوارهای با شیب در محدوده کمتر وضوح افزایش مییابد؛ زیرا یک بازه کوچک از pH در عرض کامل ژل گسترش داده میشود. از آنجایی که بسیاری از پروتئینها در محدوده میانی pH 3–۱۰ متمرکز میشوند، برخی محققان از شیبهای غیرخطی (NL) برای تفکیک بهتر پروتئینها در این محدوده و فشردهسازی بازههای pH در نواحی انتهایی شیب استفاده میکنند. با این حال، strip IPGها با دامنه محدود که دارای شیبهای همپوشان هستند، میتوانند عملکرد بهتری نسبت به شیبهای غیرخطی داشته باشند و تعداد نقاط بیشتری را برای هر نمونه به نمایش بگذارند.
استفاده از شیبهای همپوشان امکان ایجاد ژلهای ترکیبی یا سایبری را فراهم میکند که با تطبیق نقاط از نواحی همپوشان، از طریق نرمافزار تصویربرداری ایجاد میشوند. به عبارت دیگر ترکیب نتایج از چند IPG strip با محدودههای همپوشان نتایج بهتری ارائه خواهد داد. پروتئینهایی که خارج از محدوده pH نوار قرار دارند، حذف میشوند؛ بنابراین امکان بارگذاری مقدار بیشتری از پروتئین در هر نوار IPG فراهم شده و پروتئینهای بیشتری شناسایی میشوند. شکل زیر نشان میدهد که نوارهای IPG با محدوده کوچکتر، به دلیل تمرکز دقیقتر پروتئینها، نهتنها وضوح بالاتری دارند بلکه امکان نمایش تعداد بیشتری از نقاط پروتئینی را فراهم میکنند. این امر به خصوص در مطالعات پروتئومیکس و تجزیهوتحلیل پروتئینها اهمیت دارد.

قدرت و وضوح در متمرکزسازی ایزوالکتریک (IEF)
عوامل مؤثر بر وضوح در IEF شامل شیب pH، طول IPG strip و میدان الکتریکی اعمالشده هستند. هرچه شیب pH محدودتر و ولتاژ اعمالشده بالاتر باشد، تفکیک پروتئینها دقیقتر خواهد بود. استفاده از محدوده pH محدود و ولتاژ بالا باعث وضوح بیشتر در IEF میشود. بالاترین وضوح با نوارهای IPG محدوده میکرو و سیستمهای الکتروفورزی مانند PROTEAN i12 که قابلیت اعمال ولتاژهای بالا دارند، حاصل میشود. باید IEF در بالاترین ولتاژ ممکن که با نوارهای IPG و دستگاه سازگار است انجام شود.
۳. گذار از بعد اول به بعد دوم
اگر قرار باشد که بعد دوم الکتروفورز انجام شود، نوارهای IPG بلافاصله قبل از اجرای بعد دوم طی دو مرحلۀ ۱۵دقیقهای متعادل میشوند. علت این کار این است که مهاجرت پروتئینها از IPG به SDS-PAGE امکانپذیر گردد. مرحله اول نوارهای IPG در بافر تریس حاوی SDS، DTT، اوره و گلیسرول (Equilibration Buffer 1) قرار داده میشود و در مرحله دوم در محلولی مشابه (Equilibration Buffer 2) که حاوی یدواستامید به جای DTT است قرار میگیرند.
سدیم دودسیل سولفات (SDS) یک سورفکتانت آنیونی است که تقریباً تمامی برهمکنشهای غیرکووالان (پیوندهای هیدروژنی و آبگریز) را در ساختار طبیعی پروتئین برهم میزند و ساختار دوم، سوم و چهارم پروتئین را مختل میکند. دیتیوتریتول (DTT) نیز به عنوان کاهنده جهت احیای پیوندهای دیسولفیدی اضافه میشوند و به دناتوره شدن پروتئین کمک میکنند.
اهمیت این مرحله آلکیله کردن گروههای SH در پروتئینهای محلول و ممانعت از ایجاد پیوندهای دی سولفیدی بین آنها در حین الکتروفورز است. پس از این، نوارها روی سطح ژل بعد دوم قرار داده میشوند و برای تثبیت بهتر با محلول آگارز پوشانده میشوند. این کار باعث میشود که انتقال پروتئینها از بعد اول به بعد دوم بهطور منظم انجام شود و تفکیک آنها بر اساس وزن مولکولی، دقیقتر صورت بگیرد.
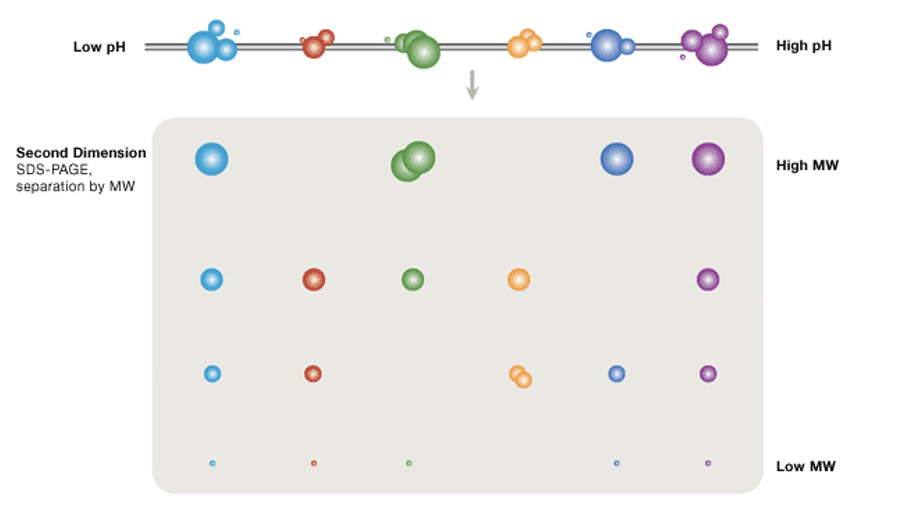
۴.بعد دوم الکتروفورز
در مرحله دوم الکتروفورز دوبعدی، از ژل پلیآکریلآمید (PAGE) استفاده میشود. پروتئینهایی که در بعد اول با روش متمرکزسازی ایزوالکتریک روی نوارهای IPG تفکیک شدهاند، در این مرحله وارد ژل پلیآکریلآمید حاوی SDS میشوند و بر اساس وزن مولکولی از یکدیگر جدا میشوند. جهت حرکت پروتئینها در این مرحله عمود بر بعد اول است.
وقتی یک مخلوط پروتئینی بهصورت افقی بر اساس بار الکتریکی و بهصورت عمودی بر اساس جرم مولکولی تفکیک شده و یک نقشه دوبعدی ایجاد میشود، هر پروتئین در آن بهعنوان یک نقطه (spot) مجزا نمایش داده میشود. معمولاً از ژلهای ۲۰×۲۰ سانتیمتری استفاده میشود و میتوان بیش از ۱۰,۰۰۰ پروتئین را از هم جدا کرد.
ترکیب ژل
ژلهای همگن (با یک درصد ثابت از آکریلآمید) معمولاً وضوح بسیار خوبی برای پروتئینهایی با وزن مولکولی در یک محدوده کوچک ارائه میدهند. ژلهای گرادیان نیز دو مزیت دارند؛ آنها امکان تجزیهوتحلیل پروتئینهایی با طیف گستردهای از وزن مولکولی را بهطور همزمان فراهم میکنند و کاهش تدریجی اندازه منافذ در طول گرادیان باعث افزایش وضوح نقاط پروتئینی میشود.
درصد آکریلآمید در ژل بر وضوح باندهای پروتئینی تأثیر میگذارد؛ درصدهای بالاتر آکریلآمید برای تفکیک پروتئینهای با وزن مولکولی پایین مفید هستند، درحالیکه درصدهای کمتر آکریلآمید برای تفکیک باندهای پروتئینی با وزن مولکولی بالاتر کاربرد دارند.
ژلهای پلیآکریلآمید ازپیشساخته و آماده برای استفاده قابل خریداری هستند یا میتوان آنها را بهصورت دستی در آزمایشگاه تهیه کرد. استفاده از ژلهای آماده باعث میشود که بین نمونهها تکرارپذیری بالایی حفظ شود و حجم کار هنگام پردازش تعداد زیادی نمونه کاهش یابد.

۵. رنگآمیزی و تصویربرداری
پس از الکتروفورز دوبعدی، پروتئینهای تفکیکشده با رنگآمیزی کوماسی بلو (Coomassie blue) یا روشهایی با حساسیت بالاتر مانند رنگآمیزی نقره یا فلورسانس، رنگآمیزی میشوند. اگر مقدار پروتئین حدود ۱۰ نانوگرم باشد، از رنگ کوماسی بلو استفاده میشود و اگر مقدار پروتئین حدود ۰.۵ نانوگرم باشد، برای تشخیص میتوان از رنگآمیزی نقرهای یا فلورسانس بهره برد. نوع رنگ مورداستفاده بسته به شرایط آزمایش و اهداف موردنظر متغیر است و همچنین به کاربردهای بعدی بستگی دارد.
الکتروفورز افتراقی فلورسانس دوبعدی (۲-D fluorescence difference gel electrophoresis) یا به اختصار 2D-DIGE نسخه بهبودیافته روش ۲-DE است که به علت نشاندارسازی فلورسنت امکان جداسازی چندین عصاره پروتئینی را روی یک ژل دوبعدی فراهم میکند.

۶. تحلیل نتایج
پس از رنگآمیزی ژلهای دوبعدی، الگوهای پروتئینی دیجیتالسازی و تجزیهوتحلیل میشوند. تحلیل تصویری رایانهای ابزار ضروری برای بررسی ژلهای دوبعدی پیچیده است؛ چراکه مقدار دادههای تولیدشده میتواند بسیار زیاد باشد و برای تحلیل آن نیاز به یک برنامه کامپیوتری است.
نرمافزارهای پیشرفته تحلیل تصویر، فرآیند بررسی دادههای دوبعدی را سادهتر کرده و کارایی تحلیل را با خودکارسازی شناسایی و تجزیهوتحلیل نقاط افزایش میدهند. این نرمافزارها اطلاعات کمی و کیفی درباره پروتئینهای موجود در نمونه را استخراج کرده و آن را در فایلهایی ذخیره میکنند.
برای مثال نرمافزار PDQuest امکان مقایسه دو یا چند تصویر ژل را فراهم میکند و به تحلیل تغییرات بیان پروتئینها در پاسخ به شرایط مختلف مانند درمانهای متفاوت یا بیماری کمک میکند. این ابزار به محققان اجازه میدهد تا تفاوتهای جزئی در میزان پروتئینها را تشخیص داده و روندهای مرتبط با تغییرات زیستی را بررسی کنند.

۷.استخراج و شناسایی نقاط پروتئینی در الکتروفورز دوبعدی
الکتروفورز دوبعدی بسیاری از پروتئینها را آشکار میکند، اما با این حال ماهیت آنها را مشخص نمیکند. هدف نهایی بسیاری از آزمایشهای ۲-DE معمولاً شناسایی پروتئینهای با بیان متفاوت است. این کار با تحلیل طیفسنجی جرمی لکههای پروتئینی مشخصشده روی ژل دوبعدی انجام میشود که شامل مراحل زیر است:
- استخراج لکههای پروتئینی موردنظر از ژل
برای استخراج لکههای پروتئینی از ژل دوبعدی، ابتدا با نرمافزارهای تحلیل تصویر مانند PDQuest محل لکهها مشخص میشود. سپس میتوان این نقاط را روی تصویر چاپ شده ژل علامتگذاری کرد و بهصورت دستی از ژل برش داد. ژل باید در هود دارای فیلتر HEPA یا با دستگاههای خودکار برش داده شود. باید از دستکش استفاده کرد و ژل را روی سطح تمیز قرار داد تا از آلودگی با کراتین ناشی از پوست و مو جلوگیری شود، چون این آلودگی میتواند تاثیر منفی روی نتایج طیفسنجی داشته باشد.
- تیمار پروتئولیتیک پروتئین
- شناسایی پروتئین از طریق طیفسنجی جرمی
پروتئینها بر اساس مقایسه جرم پپتیدها با پایگاههای داده توالی پروتئینی شناسایی میشوند. شناسایی پروتئینها در ژل دوبعدی معمولاً شروع یک پروژه پروتئومیکس است. ابزارهای پروتئومیکس ExPASy مجموعهای از محبوبترین ابزارهای آنلاین برای تحلیل محاسباتی پروتئینها بر اساس توالی اولیه آنها را ارائه میدهد.
علاوه بر روش طیف سنجی جرمی در برخی موارد، پروتئینها به غشاها منتقل میشوند تا با western blotting یا روش immunoblotting شناسایی شوند.
مزایا و معایب تکنیک الکتروفورز دوبعدی
- مزایا
- تفکیک با وضوح بالا
الکتروفورز دوبعدی، روشهای IEF و SDS-PAGE را ترکیب کرده و امکان تفکیک پروتئینها را بر اساس نقطه ایزوالکتریک و وزن مولکولی آنها فراهم میکند. این قابلیت تفکیک دوبعدی باعث میشود که الکتروفورز دوبعدی هزاران پروتئین را در نمونههای پیچیده جداسازی کرده و تفکیک با وضوح بالایی ارائه دهد.
- ایجاد پروفایل جامع پروتئینی
الکتروفورز دوبعدی به محققان امکان میدهد تا یک پروفایل جامع از پروتئینهای موجود در نمونه تهیه کنند. این امر برای کشف و شناسایی پروتئینهای جدید، مطالعه تغییرات در سطح بیان پروتئینها و تحلیل تغییرات پروتئینی بسیار حیاتی است.
- تحلیل کمی
در الکتروفورز دوبعدی به کمک نرمافزارهای تحلیل تصویر با مقایسه تراکم لکههای پروتئین مشابه در نمونههای مختلف، تغییرات بیان پروتئینها بهدقت اندازهگیری شده و دادههای کمی مهمی برای تحقیقات زیستی ارائه میشوند.
- معایب
- پیچیدگی فنی
الکتروفورز دوبعدی شامل چندین مرحله مانند آمادهسازی نمونه، متمرکزسازی ایزوالکتریک، SDS-PAGE، رنگآمیزی و تحلیل تصویر است. هر مرحله نیازمند کنترل دقیق و بهینهسازی بوده و این روش را پیچیده میکند، بهطوری که اجرای صحیح آن نیازمند سطح بالایی از مهارت است.
- تکرارپذیری پایین
بهدلیل تفاوتهای جزئی در آمادهسازی نمونه، شرایط الکتروفورز و روشهای رنگآمیزی، الکتروفورز دوبعدی اغلب قابلیت تکرارپذیری ضعیفی دارد. حتی در آزمایشهای تکراری داخل یک آزمایشگاه، نتایج میتوانند متفاوت باشند که قابلیت اطمینان و تکرارپذیری دادهها را به چالش میکشد.
- محدودیتهای نرمافزار تحلیل
با وجود دسترسی به نرمافزارهای مختلف برای تحلیل کمی تصاویر الکتروفورز دوبعدی، این نرمافزارها هنوز با چالشهایی مانند مدیریت پسزمینههای پیچیده، شناسایی پروتئینهای با فراوانی کم و تفکیک spotهای روی هم افتاده مواجه هستند. عملکرد نرمافزار مستقیماً بر دقت و قابلیت اطمینان تحلیل دادهها تأثیر میگذارد.
- نیاز به حجم بالای نمونه
الکتروفورز دوبعدی به مقدار زیادی از نمونه نیاز دارد و معمولاً نیازمند غلظتهای بالای پروتئین است تا تصاویر الکتروفورز واضحی به دست آید. این مسئله در شرایطی که تهیه نمونه دشوار یا مقدار آن محدود باشد، میتواند یک چالش محسوب شود.
علاوه بر موارد بالا باید در نظر داشت روش مرسوم ۲-DE به شناسایی پروتئینهای دناتورهشده در اندازه ۱۰ تا۲۰۰ کیلو دالتون و در بازه pH 3.5_11.5 محدود میشود؛ البته در سالهای اخیر برخی پلتفرمهای اصلاحشده ۲-DE توسعه یافتهاند که امکان شناسایی پروتئینهای غیردناتورهشده در اندازههای بسیار بزرگ یا کوچک و pIهای خاص را فراهم میکنند.
نتیجهگیری
الکتروفورز دوبعدی یکی از قدرتمندترین ابزارها برای جداسازی پروتئینها بر اساس اندازه و بار آنها است. مزیت روش الکتروفورز دوبعدی این است که پروتئینهایی که بر اساس جرم مولکولی خود در SDS-PAGE جدا میشوند را میتوان بر اساس بار، بیشتر از یکدیگر جدا کرد. روشهای اتومات مثل دستگاه Auto2D® ۲-D Electrophoresis زمان صرفشده برای بارگذاری نمونه، متمرکزسازی ایزوالکتریک، متعادلسازی و SDS-PAGE را از ۴ تا ۲۴ ساعت به تنها ۱ تا ۲ ساعت کاهش میدهد. این دستگاهها منجر به کاهش تفاوتهای بین اپراتورها و افزایش قابلیت تکرارپذیری میشوند. در هر حال الکتروفورز دوبعدی با توانایی جداسازی هزاران پروتئین و ارائه پروفایل جامع، یکی از قدرتمندترین ابزارها در پروتئومیکس است. این روش همچنان نقش کلیدی در تحلیل پروتئینها در تحقیقات زیستی ایفا میکند.
منابع:
https://doi.org/10.1016/B978-0-12-804659-3.00015-4
https://doi.org/10.1016/B978-0-12-370491-7.00005-2
https://doi.org/10.1016/B978-0-12-801814-9.00009-X
https://doi.org/10.1016/B0-12-369397-7/00120-5
https://doi.org/10.1016/j.yebeh.2019.106594
https://www.bio-rad.com/en-az/applications-technologies/second-dimension-separation?ID=LUSQMI97Q
https://www.mtoz-biolabs.com/advantages-and-disadvantages-of-2d-gel-electrophoresis-image.html
https://www.excedr.com/resources/two-dimensional-gel-electrophoresis